Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista médica (Cochabamba)
Print version ISSN 2074-4609
Rev. méd. (Cochabamba) vol.21 no.1 Cochabamba Sept. 2010
ACTUALIZACIÓN
SENSIBILIDAD Y ESPECIFICIDAD DE LOS MARCADORES TUMORALES
SENSITIVITY AND SPECIFICITY OF THE TUMOR MARKERS
Dra. Carola F. Carvajal Garcés - Médico Familiar C.N.S., carola_carvajal_g@hotmail.com
Dra. Martha Morales Clavijo - Médico Familiar C.N.S., marthamorales@hotmail.com
RESUMEN
La determinación de marcadores tumorales séricos es importante para realizar una evaluación integral de los pacientes con cáncer. No existe un marcador 100% sensible y específico. Sin embargo, son muy útiles en la detección, diagnóstico, pronóstico, valoración del tratamiento y vigilancia de los pacientes con diferentes neoplasias, ya que los niveles séricos se modifican de acuerdo al curso clínico de la enfermedad.
Palabras clave: Marcadores tumorales, evaluación, diagnóstico, pronóstico y tratamiento.
ABSTRACT
Measurement of serum tumor markers is an important method for the best evaluation of cancer patients. There is no existing a 100% sensitive and specific tumor marker. Nevertheless; some of theme are useful in screening, diagnosis, prognosis, treatment evaluation and surveillance in several cancers, and levels change with the clinic state of the disease.
Key words: Tumor markers, evaluation, diagnosis, prognosis and treatment.
El conocimiento de las pruebas de detección precoz del cáncer y la participación en los programas de salud destinados a la realización de las mismas son esenciales a la hora de cambiar las expectativas de la enfermedad. El diagnóstico precoz permite la realización de tratamientos menos agresivos, con un menor número de complicaciones y efectos secundarios. Todo ello supone una mejor calidad de vida de los pacientes y una mayor supervivencia.
La proliferación celular del cáncer requiere la interacción de numerosas proteínas, vías de señalización y tipos celulares, tanto del propio tumor como del micro ambiente que lo rodea, nutre y protege.
Los biomarcadores o marcadores tumorales se definen como alteraciones celulares, bioquímicas, moleculares o genéticas mediante las cuales se puede reconocer o monitorizar un proceso normal, anormal o simplemente un proceso biológico (1). En el ámbito de la investigación y detección del cáncer, un marcador tumoral se refiere a una sustancia o proceso que es indicativo de la presencia de cáncer en el organismo. Puede ser una molécula secretada por el tumor en sí, o una respuesta específica del organismo a la presencia del cáncer.
Los marcadores tumorales pueden utilizarse en la identificación de procesos neoplásicos, antes de que los individuos presenten síntomas, o para identificar individuos susceptibles de padecer cáncer. Para tener utilidad clínica, los biomarcadores deben tener un alto valor predictivo positivo y poder ser medidos fácilmente.
Lo ideal son biomarcadores de bajo coste y alta sensibilidad y precisión , basados en determinaciones hematológicas que precedan a cualquier prueba diagnóstica o de imágen. Con la aparición de nuevos y sensibles análisis proteómicos parece cercana la posibilidad de detectar trazas de un biomarcador en el suero de un paciente si éstos están presentes de forma específica y en estadios precoces de un determinado tumor.
En la actualidad, la investigación en marcadores tumorales está generando una gran cantidad de información.
Los avances en tecnologías, como la genómica, oncoproteómica, bioinformática y nanotecnología, están facilitando el descubrimiento de numerosos marcadores tumorales y están ayudando a generar hipótesis que deberán ser probadas de manera prospectiva en la clínica (2). A continuación se describen algunos de los marcadores tumorales que con mayor frecuencia se utilizan en el ámbito oncológico.
Los usos potenciales de los marcadores tumorales incluyen:
- Monitorización de pacientes con un cáncer establecido para detectar recurrencia.
- Detección temprana de tumores en pacientes asintomáticos.
- Ayuda en el diagnóstico de pacientes sintomáticos.
- Vigilancia de individuos con alto riesgo de sufrir cáncer.
- Estrategias de prevención primaria como la quimio-prevención.
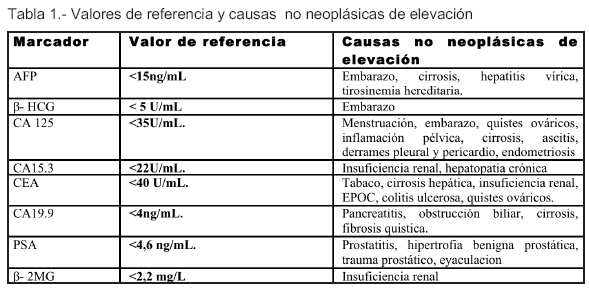
ANTÍGENO PROSTÁTICO ESPECÍFICO
El cáncer de próstata (CP) es el segundo más frecuente en el mundo en varones, con una tasa de incidencia de 25,3 por 100.000 habitantes (3).
La base de datos proporciona los datos siguientes para el cáncer de próstata en Bolivia: Número estimado de nuevos casos por año: 842.Número estimado de muertes por año: 442 Número edad-estandardizado estimado de muertes por año: 9.1/100,000, (compilado por Ferlay et al. para la Agencia Internacional para la Investigación sobre Cáncer).
La introducción del Antígeno Prostático Específico (PSA, por sus siglas en inglés) revolucionó el cribado del CP, permite una detección más temprana y como consecuencia un aumento en la incidencia; sin embargo, su utilización como herramienta de cribado es controvertida debido a cuestiones relacionadas con el beneficio en la supervivencia, el coste-efectividad y factores clínicos como la edad óptima y el nivel sérico de PSA para el que está recomendada la realización de biopsia(4,5).
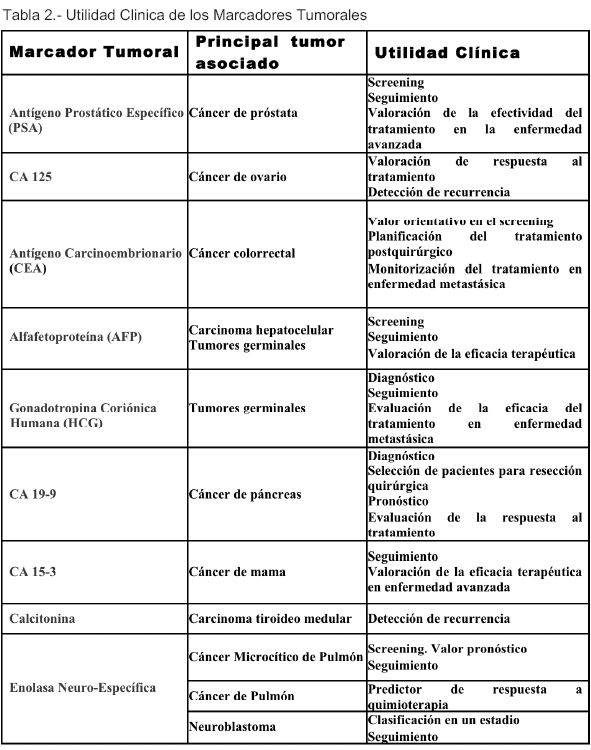
El inconveniente más importante en relación con el uso del PSA es su baja especificidad. Según Moul et al, la sensibilidad y la especificidad del punto estándar 4,0 mg/ml de PSA para detectar el cáncer de próstata fueron del 76,7% y 68,9%, respectivamente, en hombres de 70 años o más de edad. Un incremento en el nivel de PSA puede reflejar la presencia de células cancerosas, pero también puede estar relacionado con otros trastornos no malignos, como la hiperplasia benigna prostática (HBP), infección o inflamación crónica(6).
Las células neoplásicas producen niveles más bajos de PSA en comparación con las células de HBP; sin embargo, liberan una mayor cantidad de PSA al torrente sanguíneo, probablemente debido a los cambios en la arquitectura tisular presentes en el CP (7).
A pesar del debate producido en torno al cribado del CP, la realidad es que la prueba de PSA y el exámen digital rectal son parte de la revisión médica rutinaria en hombres mayores de 50 años sintomáticos. Tras la implementación de la prueba de PSA para la detección del CP, se observó un aumento en el diagnóstico del cáncer de próstata en estadío temprano, así como una disminución en la incidencia de enfermedad metastásica y una reducción en la mortalidad relacionada; sin embargo, las tasas de falsos positivos son elevadas y debemos tener en cuenta que la probabilidad de ser diagnosticado de CP es del 18% mientras que la probabilidad de muerte por CP es del 3% aproximadamente (8).
La sobre-detección puede dar lugar al sobre-tratamiento, con sus implicaciones en coste, efectos secundarios y complicaciones, de las que deben ser informados adecuadamente los pacientes (9).
Recientemente numerosos estudios han demostrado que hay una cifra elevada de tumores sin diagnosticar con este valor de corte (11).
Los datos del Ensayo de Prevención del Cáncer de Próstata -Prostate Cáncer Prevention Trial (PCPT)-demostraron que hasta un 15% de los hombres entre 62 y 91 años de edad y con un valor de PSA sérico menor de 4,0 ng/ml tienen cáncer (10).
Tradicionalmente, se ha establecido el punto de corte ideal para diferenciar CP de HBP en un valor de PSA de 4,0 ng/ml. Sin embargo, en otros estudios con varones mayores de 50 años, 136 de los 319 que presentaron CP (43%) mostraron valores de PSA<4,0 ng/ml, mientras que 148 de los 597 (25%) sin CP presentaron valores de PSA>4,0 ng/ml. En otro estudio, 332 varones asintomáticos con tacto rectal (TR) y PSA normales fueron sometidos a biopsia, encontrándose CP en 73 (22%) de ellos, todos localizados (11).
Por tanto, no hay un único valor de corte de PSA que separe los hombres con un alto riesgo de CP o enfermedad de alto grado de los hombres con riesgo bajo de sufrir la enfermedad. Basándose en estos y otros datos, la Nacional Comprehensive Cancer Network recomendó un valor de corte de 2,5 ng/ml en los Estados Unidos. No obstante, disminuir el valor de corte puede dar como resultado una gran tasa de biopsias innecesarias y mayores tasas de falsos positivos. Por tanto, la solución es integrar el PSA como una variable contínua en un modelo predictivo con otras características como la historia natural de la enfermedad y los síntomas relacionados con la calidad de vida para identificar qué pacientes pueden beneficiarse de pruebas adicionales como la biopsia prostática (11).
En la actualidad, se pretende aumentar la especificidad de la prueba para evitar biopsias innecesarias a los pacientes. Con este propósito se están investigando derivaciones de PSA, como la prueba PSA ajustada por edad (PSA se correlaciona de manera lineal con el tamaño prostático y el crecimiento prostático con la edad), la densidad de PSA (tiene en cuenta el volúmen de la glándula prostática), la velocidad de PSA (evaluaciones seriadas de la concentración del PSA sérico a lo largo del tiempo) y por último las isoformas moleculares de PSA (libres o sin unión a proteínas, y complejas o unidas a inhibidores de proteasas). Además, se investigan otros marcadores sanguíneos prometedores, como la calicreína humana glandular 2, el antígeno de cáncer de próstata temprano, el sistema de activación urokinasa plasminógeno, el factor de crecimiento transformante beta1 y la interleukina 6, la cromogranina A, la proteína secretora de próstata, el antígeno próstata-específico de membrana, los autoanticuerpos específicos de cáncer de próstata y la racimasa alfametilacetil- CoA, y la familia de factores de crecimiento similares a insulina (7).
Desde el punto de vista práctico, el PSA, al día de hoy, sigue siendo el marcador tumoral más aceptado para el diagnóstico precoz del CP combinado con la realización del tacto rectal en pacientes sintomáticos. Asímismo es válido para el seguimiento y evaluación del tratamiento en el CP. Actualmente no hay demostración científica suficiente que justifique el cribado exhaustivo del CP en los varones asintomáticos en el ámbito de la Atención Primaria (9).
CA 125
Se ha investigado un gran número de marcadores serológicos para el cáncer de ovario, pero el más comúnmente utilizado es el CA 125. Es un determinante antigénico de una glicoproteína de elevado peso molecular reconocido por un anticuerpo monoclonal que fue descubierto utilizando una línea celular de cáncer de ovario como agente inmunogénico (14).
Se observó que los niveles de CA 125 estaban incrementados en el 50% de los tumores ováricos en estadio I y en el 90% de los tumores ováricos en estadio II (15). Desafortunadamente, el CA 125 no es producido en exclusiva por los procesos neoplásicos y sus niveles pueden estar aumentados en numerosas enfermedades benignas (ginecológicas o no ginecológicas), como endometriosis, enfermedad pélvica inflamatoria, peritonitis, pancreatitis, hepatitis o pleuritis, en otros tumores como el de cuello y cuerpo del útero, páncreas, hígado, cólon, mama, pulmón, tracto digestivo, cabeza y cuello y en condiciones fisiológicas como la menstruación y el embarazo(14).
Sensibilidad y especificidad: Algunos autores han propuesto adoptar una sensibilidad media del 75%. La especificidad para valores de CA 125>U/ml varía entre el 95-99,9%.Al evaluar los niveles de CA 125 en pacientes sanas, pacientes con masas pélvicas benignas y pacientes con masas malignas, la sensibilidad de CA 125 para el diagnóstico de cáncer de ovario con un punto de corte de 35 U/ml fue del 93,3% y la especificidad fue del 79,7% (15).
Por tanto, la tasa de falsos positivos de este marcador es elevada, la evidencia existente hasta la fecha sugiere que el CA 125 como prueba única de screening, especialmente a valores superiores o iguales a 35 U/ml, no posee la suficiente sensibilidad para ser recomendada como prueba rutinaria de screening de cáncer de ovario. Su monitorización ha sido propuesta como complemento a otros métodos diagnósticos no invasivos. Una de sus características importantes es su habilidad para reflejar cambios en la masa tumoral durante la quimioterapia o en el período de seguimiento tras la finalización del tratamiento. Por ello su mayor utilidad es la monitorización de pacientes con cáncer de ovárico, para la respuesta al tratamiento y para recurrencia de la enfermedad. Si los pacientes tienen niveles elevados de CA 125 en el diagnóstico, las determinaciones seriadas de los niveles de CA 125 sérico durante el tratamiento inicial reflejan con precisión el curso de la enfermedad en más del 74% de los acontecimientos combinados (marcador frente a respuesta clínica, estabilización o progresión) (16).
El comité de consenso en el cáncer ovárico epitelial afirmó que el marcador tumoral CA 125 tiene un papel potencialmente importante en el manejo individual de los pacientes (17).
Puede tener valor como indicador temprano de fracaso del tratamiento durante la quimioterapia, así como en la confirmación de la recaída tras la cirugía. Otros marcadores tumorales potenciales que han demostrado tener sensibilidad (aunque insuficiente) o especificidad para el cáncer ovárico son el antígeno carcinoembrionario y el ácido siálico asociado a lípidos o la calicreína. Hasta ahora han sido varias las estrategias propuestas para el cribado de cáncer de ovario, que incluyen la exploración pélvica bimanual, la determinación del marcador tumoral CA-125 y la ecografía transvaginal, pero ninguna ha demostrado reducir la mortalidad(18).
La supervivencia de las mujeres con CO en estadíos precoces es significativamente mayor que en aquéllas con enfermedad avanzada.
El CA 125 aparece elevado en más del 80% de los tumores de ovario, si bien sólo en aproximadamente el 50% de los que se encuentran en etapas iniciales. Por ello, de acuerdo con la demostración científica actual, en la práctica habitual de la consulta de Atención Primaria no está recomendado el cribado sistemático de cáncer de ovario.
Actualmente, el único MT que ha sido validado en el seguimiento del CO es el CA 125. Las variaciones en las determinaciones de este marcador aportan información relevante en cuanto a la respuesta al tratamiento quirúrgico y quimioterápico y aparición de recidivas, pero su papel en el diagnóstico y pronóstico de CO no está aún del todo esclarecido.
Algunos autores han propuesto como medida para mejorar la especificidad del CA 125 su asociación al Antígeno Sérico Asociado a Cáncer (CASA), considerándola especialmente útil en los casos de tumores que no secretan cantidades importantes de CA 125.
ANTÍGENO CARCINOEMBRIONARIO
El antígeno carcinoembrionario (CEA, por sus siglas en inglés) es una glicoproteína de elevado peso molecular perteneciente a la superfamilia de las inmunoglobulinas. Su principal aplicación en la clínica asienta en los tumores gastrointestinales, especialmente en el cáncer colorrectal.
Debido a su elevada prevalencia, su prolongada fase asintomática y a la presencia de lesiones premalignas, el cáncer colorrectal es un candidato idóneo para el cribado. Los procedimientos más utilizados en el cribado de esta patología son la prueba de detección de sangre oculta en heces, la sigmoidoscopía flexible y la recto-colonoscopia.
Además, el CEA puede estar aumentado en ausencia de tumor (pacientes con enfermedad hepática benigna e individuos fumadores, por ejemplo).
El CEA puede también estar aumentado en otros tumores, como melanoma, linfoma y cáncer de mama (en este tumor la detección de CEA está indicada para monitorizar pacientes con enfermedad metastásica durante el tratamiento junto con pruebas confi rmatorias), pulmón, páncreas, estómago, cuello del útero, vejiga, riñón, tiroides, hígado y ovario. Por tanto, en el cribado el CEA es útil únicamente cuando los síntomas sugieren un adenocarcinoma colorrectal, y acompañado de otras pruebas confirmatorias (19).
La detección del CEA está indicada en pacientes con carcinoma colorrectal para ayudar a confirmar el estadio y planificar la cirugía. En este caso, un CEA prequirúrgico aumentado (por encima de 5 mg/ml) puede correlacionarse con mal pronóstico, aunque por el momento los datos son insuficientes para determinar si un paciente debe recibir tratamiento adyuvante. Además, la detección de este marcador está indicada de manera postquirúrgica para vigilar la aparición de metástasis cada 6 meses en pacientes con estadio II o III durante los 5 años posteriores al diagnóstico de la enfermedad. Sin embargo, por sí solo, un CEA elevado no justifica el tratamiento sistémico para enfermedad metastásica (20).
El CEA se utiliza para monitorizar la respuesta al tratamiento durante la terapia sistémica. Se debe medir al inicio del tratamiento y cada 1-3 meses. Valores aumentados de CEA de manera persistente sugieren progresión de la enfermedad, incluso en ausencia de radiografías que lo corroboren. Sin embargo, hay que tener en cuenta que en el inicio de un nuevo tratamiento, los niveles de CEA suelen aumentar.
A pesar de ser el marcador de mayor antigüedad es el mejor para cáncer colorrectal. Debido a sus limitaciones en la sensibilidad y especificidad (valores del 79,9% y del 88,2%, respectivamente), están en estudio otros marcadores potenciales para el cribado de cáncer colorrectal, tales como el CA 19-9, CA 242, CA 72-4, CA 50, TPA, TPS y TIMP-131. (21)
En la práctica habitual, los niveles séricos de CEA tienen valor orientativo en el cribado de un tumor de cólon si se encuentran elevados, siempre que se acompañen de otra prueba diagnóstica sugerente de neoplasia, para decidir si administrar o no un tratamiento quimioterápico adyuvante en pacientes intervenidos quirúrgicamente de un estadio II o B de Dukes, y por último para valorar la eficacia del tratamiento quimioterápico administrado en la enfermedad metastásica. En el ámbito de la Atención Primaria este marcador sólo debe ser solicitado en las situaciones anteriormente descritas y en pacientes en seguimiento por Atención Especializada; no está indicado como prueba aislada de cribado (22).
Cifras elevadas en el CEA preoperatorio se han considerado indicadoras de peor pronóstico, especialmente aquéllas que no descienden tras la cirugía y se asocian a mayor incidencia de recurrencias tras resección quirúrgica del tumor. Slentz et at. encontraron en 1994 que el peor pronóstico lo tenían aquéllos cuyas cifras de CEA se encontraban elevadas antes y después del tratamiento (66% supervivencia a los 5 años), en comparación con aquéllos que mostraron cifras elevadas antes pero no después del mismo (supervivencia 88% a los 5 años) y aquéllos que mostraron cifras normales tanto antes como después del tratamiento (supervivencia 93% a los 5 años). El grado de la elevación del CEA parece correlacionarse con el estadio del tumor (Dukes), de tal forma que valores superiores a 20 ng/ml son indicativos de enfermedad avanzada de forma casi inapelable. Clásicamente, Wanebo et al. establecieron una asociación entre la elevación del CEA por encima de 5 ng/ml y el estadiaje del tumor: 4% Dukes A, 26% Dukes B, 44% Dukes C, 65% Dukes D y 72% en pacientes con enfermedad recurrente o metastásica(23).
Podemos concluir que el papel de la monitorización del CEA en el seguimiento del CCR sigue siendo controvertido. Hoy por hoy, no existe evidencia suficiente para recomendar la monitorización seriada de CEA en los pacientes diagnosticados de CCR. No obstante, la ASCO recomienda que se determine el CEA cada 2 ó 3 meses durante al menos los dos primeros años tras el diagnóstico de CCR en estadío II o III. Una elevación aislada debe confirmarse analíticamente. Una vez confirmada, una ampliación del estudio está indicada (escáner abdominal y pélvico, radiografía de tórax y, en ocasiones, colonoscopia). Esta indicación sólo es válida en pacientes susceptibles de recibir cirugía que suponga un claro beneficio potencial (24).
Actualmente, está abierta una nueva y prometedora vía de investigación sobre el CEA: los anticuerpos policlonales y monoclonales anti-CEA. Parece que han demostrado ser capaces de detectar tumores que incluso pasan desapercibidos en las pruebas de imagen.
ALFAFETOPROTEÍNA
La alfafetoproteína (AFP, por sus siglas en inglés) es una glicoproteína formada en el feto en desarrollo que ha sido utilizada desde 1963 como marcador tumoral para el carcinoma hepatocelular (HCC); se ha establecido su detección en estos pacientes como prueba rutinaria en la clínica. Tras el nacimiento, los niveles séricos de este marcador disminuyen a valores inferiores a 10 ng/ml. Se pueden encontrar niveles elevados en otros tipos de cáncer, como el tumor de las células germinales del ovario o testículo o el carcinoma gástrico productor de AFP. Además, pueden encontrarse niveles aumentados en otras patologías benignas del hígado, como la hepatitis aguda y crónica. Se ha estudiado su valor como herramienta para el cribado del HCC, teniendo como objeto de estudio pacientes con diferentes tipos de infección viral, gravedad de la enfermedad hepática. En estos estudios, la AFP ha demostrado tener una sensibilidad del 39%-65%, una especificidad del 76%-94% y un valor predictivo positivo del 9%-50%. La especificidad y la sensibilidad dependen de la prevalencia de HCC en la población así como del valor de corte elegido para el diagnóstico, aunque no dependen del tipo de infección vírica(25).
Valores de alfafetoproteína mayores de 400 ng/ml se consideran generalmente diagnósticos de HCC, aunque es difícil encontrar estos valores en el cribado de estos pacientes. Por tanto, un incremento progresivo en los valores, aun por debajo de 400 ng/ml, puede hacer sospechar la presencia de HCC y requiere confirmación con otras técnicas diagnósticas (26).
Desde el punto de vista práctico la AFP tiene valor tanto en el cribado como en el seguimiento y valoración de la eficacia terapéutica en el HCC y en los pacientes con tumores germinales.
GONADOTROPINA CORIÓNICA HUMANA
La gonadotropina coriónica humana (HCG, por sus siglas en inglés) es una glicoproteína producida por los trofoblastos placentarios a una elevada concentración.
Durante el embarazo, las concentraciones séricas se incrementan rápidamente con un pico a las 710 semanas. Fuera del ámbito gestacional no debe detectarse elevación de HCG. Por tanto, si se descarta el embarazo, una elevación en los niveles de esta hormona es indicativa de cáncer (26).
En los tumores de células germinales, concentraciones elevadas de HCG, AFP o LDH en suero están asociadas con un mal pronóstico. Una concentración sérica de HCG mayor de 1.00010.000 UI/l es un factor pronóstico importante, y el riesgo se incrementa con el aumento en las concentraciones de este marcador (27).
En la monitorización del tratamiento de estos pacientes la HCG se utiliza para valorar la respuesta a la terapia. Para ello se determina HCG y se realiza tomografía computarizada (TC) a intervalos de 2 a 4 semanas durante el primer año e intervalos más espaciados posteriormente hasta 5 años. Además, este marcador posee una elevada especificidad (98%) y sensibilidad (87%) en la detección de recaídas tras la cirugía y durante el tratamiento adyuvante de estos pacientes.
CA 19-9
Es un marcador descubierto a partir de un medio de cultivo de una línea celular de cáncer colorrectal. Fue propuesto de manera inicial como marcador serológico para el cáncer colorrectal; sin embargo, actualmente su utilización no se recomienda en este tipo de cáncer, mientras que sí se evalúa en pacientes con cáncer pancreático o biliar, por su mayor especificidad en estas patologías.
Numerosos estudios han descrito el papel de CA 19-9 en el diagnóstico del cáncer de páncreas. En estos estudios la mediana de sensibilidad para el diagnóstico del cáncer pancreático fue de 79% (7090%) y la mediana de especificidad fue de 82% (68-91%). La mediana del valor predictivo positivo fue de 72% y la del valor predictivo negativo fue de 81%. Además de su valor diagnóstico, se ha sugerido un valor pronóstico para CA 19-9. La determinación de la concentración de CA 19-9 puede ser aplicada en tres grandes áreas de manejo del cáncer de páncreas. En primer lugar, puede tener un papel en la selección de pacientes para la resección quirúrgica; se ha observado una correlación inversa entre concentraciones elevadas de CA 1 9-9 prequirúrgico y supervivencia postquirúrgica. En segundo lugar, en pacientes con cáncer avanzado se ha observado una correlación independiente entre concentraciones basales de CA 19-9 y supervivencia. Por último, la concentración de CA 19-9 puede utilizarse como m arcador de resp u esta al tratam i en to. Desafortunadamente se han observado niveles de CA 19-9 en otros tumores como el cáncer gástrico y ovárico, y en otras condiciones benignas como la fibrosis quística, hidronefrosis y la tiroiditis de Hashimoto. Además, una concentración sérica elevada de CA 19-9 puede asociarse con varias patologías que producen una reducción en el drenaje biliar, especialmente la colangitis. Sin embargo, se cree que las patologías benignas causan una elevación moderada de la concentración de este marcador, mientras que los tumores causan grandes elevaciones.
CA 15-3
Se ha estudiado un gran número de marcadores tumorales para el cribado, valoración del pronóstico, predicción de la recurrencia y monitorización de la respuesta al tratamiento del cáncer de mama. Uno de los más utilizados es el CA 15-3, empleado en la detección y monitorización del cáncer de mama metastásico. En la actualidad aún no se ha encontrado un marcador tumoral para el cribado del cáncer de mama, y éste sólo es posible mediante la realización de una mamografía. La utilización de CA 15-3 en el cribado del cáncer de mama, por tanto, no está recomendada (16).
En el diagnóstico del cáncer de mama el CA 15-3 tiene falsos positivos ya que pueden existir niveles elevados de este marcador en enfermedades benignas, sobre todo en patologías hepáticas; por ello no es efectivo en el diagnóstico del cáncer de mama.
Ha demostrado ser más efectivo que otros marcadores en la valoración de la respuesta al tratamiento.
Cuando se utiliza un punto de corte que permite una especificidad del 97,5%, la sensibilidad disminuye al 50%-70% en la enfermedad avanzada y al 5-25% en la enfermedad local. En un meta-análisis se demostró que 66% de los pacientes en tratamiento para cáncer de mama avanzado tenía niveles de CA 15-3 que disminuían con la respuesta al tratamiento; en 73% de los pacientes con enfermedad estable no se demostró ningún cambio en sus niveles séricos de CA 15-3, mientras que 80% de los pacientes cuyos niveles de CA 15-3 estaban aumentados experimentó progresión(17).
Los cambios en las mediciones seriadas pueden ser útiles en la valoración del curso de la enfermedad, y se ha demostrado que aproximadamente 75-80% de los pacientes con progresión de cáncer de mama tienen elevaciones en éste u otros marcadores. Sin embargo, en 30% de los casos el CA 15-3 fracasa en la valoración de la respuesta al tratamiento.
Por tanto, desde el punto de vista práctico, CA 153 tiene utilidad limitada en el seguimiento y en la valoración de la eficacia terapéutica del cáncer de mama avanzado, por lo que se ha considerado otros marcadores tumorales como: Receptores de estrógenos (RE) y progesterona (RP), Contenido de DNA, Velocidad de crecimiento,Oncogén HER-2/NEU(28).
CALCITONINA
El carcinoma tiroideo medular (CTM) se produce a partir de las células C tiroideas que producen calcitonina. La calcitonina es un marcador sensible y específico de la enfermedad. La sensibilidad de la evaluación de calcitonina basal para predecir CTM antes de la cirugía es de 100%, mientras que la especificidad es de 95%58. Además, a menudo se diagnostican recurrencias clínicas en una etapa temprana gracias a los niveles aumentados de calcitonina; sin embargo, la supervivencia tras la recurrencia puede ser de décadas.
Como en otros tumores, el pronóstico en esta enfermedad está relacionado con la carga tumoral y la tasa de progresión, con lo que la valoración de estas dos características puede permitir la selección de nuevos tratamientos y la interpretación de la enfermedad estable durante el tratamiento en pacientes con un CTM agresivo.
Desde un punto de vista práctico, se recomienda realizar determinaciones repetidas de la concentración de calcitonina en el caso de concentraciones persistentemente anormales tras tiroidectomía total y disección nodal bilateral. Tras decidir la intervención terapéutica más apropiada, en pacientes de bajo riesgo se debe continuar la monitorización de los niveles de calcitonina cada 6 meses. En los pacientes de alto riesgo se deben barajar opciones terapéuticas agresivas (cirugía, radioterapia, radioinmunoterapia (29).
ENOLASA NEURONO-ESPECÍFICA
La enolasa neurono-específica (NSE, por sus siglas en inglés) es una enzima presente en las neuronas, tejido neuroendocrino periférico y tumores de la serie celular del sistema APUD (amine precursor uptake and degradation system), dentro de los cuales se incluyen el cáncer de pulmón de células pequeñas y el neuroblastoma. La NSE se expresa en otros tumores, como el melanoma, seminoma, carcinoides y tumores de células de Merkle. En el cribado del cáncer de pulmón de células pequeñas (SCLC, por sus siglas en inglés) la determinación de los niveles de NSE tiene una sensibilidad de 42-87% con un valor de corte de 10-15 ng/ml. Según Pinson et al, la sensibilidad y especificidad de NSE en el diagnóstico de este tumor, con un valor de referencia de 12,5 ng/ml, fueron 4 y 83%, respectivamente. Como factor pronóstico, Jonson et al demostraron, en un análisis multivarianza de 154 pacientes que habían recibido quimioterapia para SCLC, que tanto la NSE como el estado general y la albúmina sérica eran los mejores predoctores independientes de supervivencia.
En el neuroblastoma, la NSE es un buen marcador y se correlaciona con el estadio del tumor; es particularmente útil en la distinción del estadio IV del estadio(menos agresivo) IVS en niños menores de un año de edad. La NSE no es específica de neuroblastoma y pueden encontrarse niveles aumentados en el tumor de Wilms y en el carcinoma renal.
La NSE se encuentra aumentada en otros tipos de tumores, como el melanoma, el seminoma, el carcinoma de células renales, tumor de células de Merkel, tumores carcinoides, disgerminomas y teratomas inmaduros, algunos casos de feocromocitoma maligno y tumores pancreáticos indiferenciados de células pequeñas(29). En resumen, la NSE ha demostrado ser un buen marcador en varios tipos de tumores, principalmente el cáncer de pulmón de células pequeñas y el neuroblastoma.
Su mayor utilidad reside, quizás, en el seguimiento clínico de los pacientes.
BETA-2 MICROGLOBULINA
La beta-2 microglobulina (B2M) es un polipéptido de bajo peso molecular que forma parte del complejo mayor de histocompatibilidad (HLA) de clase I y puede encontrarse en la membrana de casi todas las células nucleadas. Debido a ello y a la similitud de su secuencia de aminoácidos con la región constante de las inmunoglobulinas, se cree que esta proteína desempeña un papel importante en la función inmune.
La B2M se filtra prácticamente en exclusiva en el glomérulo renal y se reabsorbe casi en su totalidad en las células de los túbulos proximales en condiciones fisiológicas.
La fuente principal de B2M en el suero y otros fluidos corporales es la renovación de la membrana celular. Por tanto, los niveles séricos de B2M reflejan la función renal y la renovación celular, lo que se asocia a masa tumoral y tasa de crecimiento.
Se ha demostrado que los niveles elevados de B2M son indicativos de una escasa supervivencia en varias patologías malignas hematológicas, como el mieloma múltiple, los linfomas de grado bajo, linfomas de células grandes, linfoma de Hodgkin, leucemia linfoblástica aguda, leucemia mieloide crónica con cromosoma Philadelphia positivo,
RECEPTORES HORMONALES
El cáncer de mama representa una enfermedad heterogénea en la que se utilizan marcadores específicos para predecir la respuesta al tratamiento y clasificar a los pacientes en diferentes grupos según su pronóstico cuando se combinan estos marcadores con la información relacionada con el tamaño tumoral, grado, afectación ganglionar. Los marcadores utilizados con estos fines en las muestras de biopsia son el receptor de estrógenos (RE), el receptor de progesterona (RP) y el receptor 2 del factor de crecimiento epidérmico humano (HER-2/neu, por sus siglas en inglés). El receptor de estrógenos es el factor predictor individual más potente en el cáncer de mama. La exposición a los estrógenos es un factor de riesgo fundamental en el cáncer de mama, por lo que este receptor es importante en el proceso de carcinogénesis y en su inhibición mediante la terapia endocrina (directamente utilizando los Moduladores Sel ectivos del Receptor de Estrógenos, o indirectamente bloqueando la conversión de andrógenos a estrógeno utilizando los inhibidores de la aromatasa).
El receptor de progesterona es un gen regulado por los estrógenos por lo que su expresión puede indicar que el receptor de estrógenos está presente y su cascada de señales está activada. Por tanto, el RP debe, en teoría, ayudar a predecir la respuesta al tratamiento hormonal de una manera más precisa. La determinación de los RE y RP se ha convertido en rutinaria en la práctica clínica diaria con los l eu cemi a l i n focíti ca crón i ca y sín drom es mielodisplásicos.
Sin embargo, y debido a que la B2M se reabsorbe y cataboliza en el riñón, su cuantificación en la orina es un fiel índice de daño tubular proximal; ésta es su primera y más conocida aplicación clínica(29).
pacientes con CM, debido a que parecen tener cierta importancia a la hora de predecir la respuesta al tratamiento hormonal. Aún queda por resolver cuál es la mejor forma de dar los resultados (considerar positivo a cualquier tumor que tiña de receptor más del 5% de sus células, tener en cuenta la intensidad de la tinción y el número de células teñidas, emplear técnicas de imagen, etc.). Independientemente de que un resultado positivo para RE pueda tener significado pronóstico en algunos tipos de tumores (algunos carcinomas ductales in situ), actualmente no existe evidencia científica que apoye la determinación rutinaria de receptores de hormonas con este fin en los pacientes con CM.
El receptor HER-2/neu tiene un papel importante en la diferenciación, adhesión y motilidad celular. Los tumores HER-2+ se asocian con un alto grado, afectación ganglionar y mayor tasa de recurrencia y mortalidad; por tanto, este receptor es indicativo de mal pronóstico. Además, HER-2 es un factor predictor de respuesta a diferentes terapias sistémicas (trastuzumab, quimioterapia con antraciclinas y taxanos).
Existe evidencia de que este oncogén identifica un subgrupo de pacientes que mostrarán buena respuesta al tratamiento quimioterápico, por lo que es un marcador a tener en cuenta hoy en día y con grandes esperanzas depositadas en él para el futuro.(28)
Desde el punto de vista práctico, la evaluación de estos receptores h a su pu esto un a ayuda fundamental en el manejo del cáncer de mama.
En la actualidad se han identificado seis subtipos en el cáncer de mama según perfiles de expresión génica de estos receptores. Estos perfiles suponen diferencias significativas en cuanto a supervivencia y respuesta al tratamiento.Por tanto, el análisis de la expresión de los receptores hormonales en el cáncer de mama es importante para clasificar a las pacientes en los diferentes subtipos, con vistas a administrar el tratamiento más adecuado (30).
Referencias Bibliográficas.-
1. Rivera P. Utilidad Clínica de los marcadores tumorales. Rev MexPat Clin 1997; 44: 245-258. [ Links ]
2. Enguídanos M, Todoli J, Saro E, Salvador G, Villar J, Gómez-Biedma S, Calabuig J, Mico L. Utilidad de los marcadores tumorales en el diagnóstico de neoplasia asociada a trombosis venosa profunda idiopática. Ann Med Int 2002; 19: 561-566. [ Links ]
3. Rubial A. Marcadores tumorales de secreción: situación actual. Med Clin (Barc) 2002; 118:750-756. [ Links ]
4. American Cáncer Society. ACS prostate screening guide-line 1997. Update of the 1993 recommendations. Cáncer J Clin 1997;47(5): 261-4. [ Links ]
5. American College of Physicians-American Society of Internal Medicine (ACP-ASIM). Early detection of prostate cáncer. Ann Intern Med 1997; 126: 394-406. [ Links ]
6. Canadian Urological Association. Guidelines for early detection of prostate cáncer. Can J Oncol 1994; 4(S1): 82-5. [ Links ]
7. National Cáncer Institute Physician Statement: Screening for prostate cáncer. (Updated may 2000). National Cáncer Institute report (www.nci.nih.gov). [ Links ]
8. US Preventive Services Task Forcé (2nd ed). Guide to clinical preventive services. Baltimore: US Preventive Services Task Forcé. Williams and Wilkins, 1996. Gómez TF, Álvarez-Sala R. Marcadores tumorales en el cáncer de pulmón. Rev Patol Respir 2002; 5: 53
9. De la Peña J. Antígeno prostético específico. Revisión bibliográfica. Rev Sanid Milit 1996; 50: 177-184. [ Links ]
10. Marzo Castillejo M BBB, Ruin Villanueva M, Cierco Peguera P,Moreno Baquerano M. Estrategias de prevención del cáncerAten Primaria 2007;39:47-66. [ Links ]
11. Teresa Romero G CVV, Jimeno Cargues A. Utilización de marcadores tumorales en Atención Primaria. Medifam 2002;12:13-37. [ Links ]
12. Martín Suárez A, Alonso Díaz L, Ordíz Álvarez I, Vázquez J, Vizoso Piñeiro F. Utilidad clínica de los marcadores tumorales séricos. Aten primaria 2003; 32: 227-39 [ Links ]
13. Haga Y, Sakamoto K, Egami H. Evaluation of serum CA 125 valúes in healthy individuáis and pregnant women. Am J Med Sci 1986; 292: 25-9. [ Links ]
14. Jacobs I, Bast RC. The CA 125 tumour-associated antigen: a review of the literature. Human Reproduction 1989; 4: 1-12. [ Links ]
Perkins Gl, Evans MD, Slater D, Sanders GK, Prichard JG. Serum tumor markers. American Family Physician 2003; 68 1075-82.
15.- Martínez E, Marcos M, Domínguez MA, Arias F, Villafranca E, Dueñas MT. Anales Sis San Navarra 2000; 24 (Supl. 1): 53-61 [ Links ]
16.- Sturgeon C. Practice guidelines for tumor marker use in theclinic. Clin Chem 2002;48:1151-9. [ Links ]
17.- Gálvez Ibáñez. Marcadores tumorales. Utilización por el médico de familia. FMC 2000; 7 (Supl 5): 21-6. [ Links ]
18. Molina R, Fuella X, Ballesta AM. Marcadores tumorales. Utilidad clínica en el cáncer de mama y en neoplasias epiteliales ováricas. FMC 2000; 7 (Supl 5): 30-5. [ Links ]
19.- Programa de Actividades Preventivas y Promoción de la Salud (PAPPS). Sociedad Española de Medicina de Familia y Comunitaria (semFYC). Barcelona, 1999. [ Links ]
20.- American College of Physicians-American Society of Internal Medicine (ACP-ASIM). Early detection of colorectalcancer. Ann Intern Med 1997; 126: 394-406. [ Links ]
21.- Duffy MJ. Carcinoembryonic antigen as a marker for colorectal cáncer: ¡s ¡t clinically useful? Clin Chem 2001;47:624-30. [ Links ]
22.- Burt RW. Colon cáncer screening. Gastroenterology 2000; 119:837-53. [ Links ]
23.- Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, Somerfield MR, Hayes DF, Bast RC, Jr. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cáncer. J Clin Oncol 2006;24:5313-27.
24.- Fletcher RH. Carcinoembryonic antigen. Ann Intern Med 1986, 104:66-73. [ Links ]
25.- Harris L, Fritsche H, Mennel R, Norton L, Ravdin P, Taube S, Somerfield MR, Hayes DF, Bast RC, Jr. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cáncer. J Clin Oncol 2007;25:5287-312.
26.- Adachi Y, Tsuchihashi J, Shiraishi N, Yasuda K, Etoh T, Kitano S. AFP-producing gastric carcinoma: multivariate analysis of prognostic factors in 270 patients. Oncology 2003;65:95-101. [ Links ]
27.- Daniele B, Bencivenga A, Megna AS, Tinessa V. Alpha-fetoprotein and ultrasonography screening for hepatocellular carcinoma. Gastroenterology 2004;127:S108-112. [ Links ]
28.- Ruiball A. El concepto actual de marcador tumoral. En: El cáncer de mama: biología y marcadores tumorales. Ene Ed.1996. Pag 25. [ Links ]
29.- Martín Suárez A, Alonso Díaz L, Ordíz Álvarez I, Vázquez J, Vizoso Piñeiro F. Utilidad clínica de los marcadores tumorales séricos. Aten primaria 2003; 32: 227-39
30.- Perkins Gl, Evans MD, Slater D, Sanders GK, Prichard JG. Serum tumor markers. American Family Physician 2003; 68:1075-82 [ Links ]