Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.39 Oruro Dec. 2016
ARTÍCULOS ORIGINALES
Predicción de la solubilidad del Li2SO4.H2O utilizando el modelo de Pitzer
Predicting the solubility of the Li2SO4.H20 using the Pitzer model
Predição da solubilidade do Li2SO4.H20 usando o modelo de Pitzer
Fausto Alfredo Balderrama Flores
Carrera de Ingeniería Metalúrgica y Ciencia de Materiales Universidad Técnica de Oruro
faustoabf@gmail.com
Resumen
Durante una de las etapas de evaporación-cristalización de las salmueras del salar de Uyuni, cristaliza una mezcla de sales, ricas en ![]() a partir de la cual se puede obtener
a partir de la cual se puede obtener ![]() .
.
En este trabajo se ha utilizado el modelo termodinámico de interacción iónica de Pitzer, para la predicción de la solubilidad del ![]() en solución acuosa a 25 °C. Inicialmente se ha elaborado un programa en Excel para la estimación de parámetros del modelo de Pitzer,
en solución acuosa a 25 °C. Inicialmente se ha elaborado un programa en Excel para la estimación de parámetros del modelo de Pitzer, ![]() , para soluciones de sales de electrolitos a partir de datos experimentales de coeficientes de actividad. Para soluciones acuosas de sulfato de litio los valores estimados son: 0,14344, 1,12698 y -0,00544 respectivamente. Posteriormente, para la predicción de la solubilidad, se ha elaborado otro programa en el que los datos de entrada son la constante del producto de solubilidad de la sal y los parámetros
, para soluciones de sales de electrolitos a partir de datos experimentales de coeficientes de actividad. Para soluciones acuosas de sulfato de litio los valores estimados son: 0,14344, 1,12698 y -0,00544 respectivamente. Posteriormente, para la predicción de la solubilidad, se ha elaborado otro programa en el que los datos de entrada son la constante del producto de solubilidad de la sal y los parámetros ![]() . Para un valor KPS de 2,62 a 25 °C, y los parámetros anteriormente estimados, el valor calculado para la solubilidad del
. Para un valor KPS de 2,62 a 25 °C, y los parámetros anteriormente estimados, el valor calculado para la solubilidad del ![]() es de 3,130 molal. El valor experimental es de 3,131 molal. Finalmente utilizando valores de parámetros del modelo de Pitzer y constantes del producto de solubilidad, reportados en la literatura técnica, se han calculado solubilidades para diferentes sales que constituyen la salmuera del Salar de Uyuni.
es de 3,130 molal. El valor experimental es de 3,131 molal. Finalmente utilizando valores de parámetros del modelo de Pitzer y constantes del producto de solubilidad, reportados en la literatura técnica, se han calculado solubilidades para diferentes sales que constituyen la salmuera del Salar de Uyuni.
Palabras clave: Modelo de Pitzer, solubilidad de sales, ![]() , modelación, Salar de Uyuni.
, modelación, Salar de Uyuni.
Abstract
During one of the stages of evaporation-crystallization of the Uyuni salt lake brines, a mix of salt rich in Li2SO4.H20 crystallizes, from which it is possible to obtain Li2CO3.
In this paper it has been used the thermodynamic model of ion interaction of Pitzer for predicting the Li2SO4.H2O solubility in aqueous solution at 25 °C. Initially a program in Excel for estimating the Pitzer model parameters for electrolytic salt solutions from experimental data of activity coefficients has been developed. For aqueous solutions of lithium sulphate the estimated values are: 0.14344, 1.12698 and -0.00544 respectively. Subsequently, for the prediction of the solubility, another program has been developed in which the input data is the constant of salt solubility product constant and the Pitzer parameters. For a KPS value of 2.62 at 25 °C and the parameters estimated above, the calculated value for the solubility of ![]() is 3.130 molal. The experimental value is 3.131 molal. Finally, using Pitzer model parameters and solubility product constants reported in the literature, the solubility for different salts, which are part of the Uyuni salt lake brines, have been calculated.
is 3.130 molal. The experimental value is 3.131 molal. Finally, using Pitzer model parameters and solubility product constants reported in the literature, the solubility for different salts, which are part of the Uyuni salt lake brines, have been calculated.
Keywords: Pitzer model, solubility of salts, Li2SO4.H2O, modelling, Uyuni salt lake.
Resumo
Durante uma das fases de evaporação-cristalização das salmouras do salar de Uyuni, cristaliza uma mistura de sais ricas em Li2SO4.H20, a partir da qual pode-se obter Li2CO3.
Neste artigo tem sido utilizado o modelo termodinâmico de interação iónica de Pitzer, para predizer a solubilidade de Li2SO4.H2O em solução aquosa a 25 °C. Inicialmente, foi desenvolvido um programa em Excel para estimar os parâmetros do modelo de Pitzer para soluções de sais de eletrólitos baseado nos dados experimentais dos coeficientes de atividade. Para soluções aquosas de sulfato de lítio os valores estimados são: 0,14344, 1,12698 e -0,00544 respectivamente. Subsequentemente, para a predição da solubilidade, outro programa foi desenvolvido no qual os dados de entrada são a constante de produto de solubilidade do sal e os parâmetros de Pitzer. Para um valor KPS de 2,62 a 25 ° Ce os parâmetros de Pitzer estimados anteriormente, o valor calculado para a solubilidade de ![]() é 3,131 molal. O valor experimental é 3,131 molal. Finalmente, usando parâmetros do modelo Pitzer e constantes do produto de solubilidade relatados na literatura técnica, foram calculadas solubilidades para diferentes sais que constituem a salmoura do salar de Uyuni.
é 3,131 molal. O valor experimental é 3,131 molal. Finalmente, usando parâmetros do modelo Pitzer e constantes do produto de solubilidade relatados na literatura técnica, foram calculadas solubilidades para diferentes sais que constituem a salmoura do salar de Uyuni.
Palavras chave: Modelo de Pitzer, solubilidades de sais, ![]() , modelamento, salar de Uyuni.
, modelamento, salar de Uyuni.
1. Introducción
Bolivia posee muchos salares en la región sudoeste del país, siendo el más importante por su extensión y riqueza el salar de Uyuni [1,2].
La salmuera del Salar de Uyuni es rica, especialmente por su contenido en litio y potasio, pero compleja. Contiene iones Li+, Na+, K+, Mg2+, Ca2+, B, Cl-, SO42- y su relación Mg/Li es alta, de aproximadamente 20/1.
La obtención de sales a partir de salmueras es realizada principalmente por cristalización fraccionada. Normalmente, la salmuera del salar es bombeada a una serie de piscinas solares donde se obtienen cristales de diferentes sales.
Durante la evaporación-cristalización de las salmueras del Salar de Uyuni, se ha encontrado que en una de las etapas cristaliza una mezcla de sales rica en Li2SO4.H2O, a partir de la cual se puede obtener carbonato de litio, un producto comercial y de amplia demanda mundial actual [3].
La determinación de la sal o mezcla de sales que cristalizan en un determinado sistema, requiere el conocimiento del equilibrio sólido-líquido de dicho sistema, lo que a su vez requiere el conocimiento de los coeficientes de actividad de los electrolitos presentes en las salmueras en el rango de concentración de diluidas a saturadas.
Los modelos para el cálculo de coeficientes de actividad de Debye-Huckel, Debye-Huckel extendida y Davies sólo predicen los coeficientes de actividad hasta máximo 0,05, 0,1 y 0,5 molal respectivamente, a mayores concentraciones presentan errores muy grandes [4, 5]. El modelo de interacción iónica de Pitzer tiene un rango de aplicación mucho mayor y ha sido aplicado con éxito a soluciones con alta fuerza iónica [6], como son las salmueras.
En este artículo se ha utilizado el modelo de interacción iónica de Pitzer, para el cálculo de coeficientes de actividad y para la predicción de la solubilidad del Li2SO4.H2O a 25 °C.
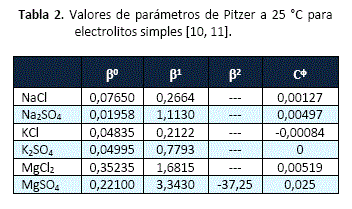
También, se han utilizado parámetros del modelo de Pitzer, y valores de productos de solubilidad reportados por la literatura técnica [7], para la predicción de otras sales presentes en las salmueras del Salar de Uyuni.
En trabajos posteriores se verán la dependencia de la solubilidad del Li2SO4.H2O con la con la composición de las otras sales disueltas en la salmuera y con la temperatura.
2. Fundamento teórico
La reacción de disolución de la sal sólida Li2SO4.H2O, ocurre de acuerdo a la reacción:
![]()
Su constante de equilibrio está dada por:
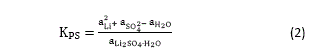
Como aLÍ2So4.H2o = 1 y ai = Yi mi, se tiene que:
![]()
Donde ![]() es la actividad del componente i, y¡ es el coeficiente de actividad del componente i y mi es la molalidad del componente i.
es la actividad del componente i, y¡ es el coeficiente de actividad del componente i y mi es la molalidad del componente i.
El coeficiente de actividad medio del Li2SO4 está definido como:
![]()
Y si la solubilidad del ![]() a la temperatura y presión dadas es m, en mol/kgw, se tiene que:
a la temperatura y presión dadas es m, en mol/kgw, se tiene que:
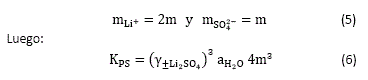
Para calcular la solubilidad, m, del ![]() , utilizando la ecuación (6), se requiere conocer el valor de KPS y se debe realizar un proceso iterativo de cálculo y error, en la búsqueda de m, debido a que el coeficiente de actividad medio y la actividad del agua son funciones de m.
, utilizando la ecuación (6), se requiere conocer el valor de KPS y se debe realizar un proceso iterativo de cálculo y error, en la búsqueda de m, debido a que el coeficiente de actividad medio y la actividad del agua son funciones de m.
La constante del producto de solubilidad, KPS, puede ser calculada a partir de datos termodinámicos utilizando la ecuación:

Donde AG°, es la energía libre estándar de reacción, R la constante universal de los gases igual a 1,987 cal/(mol.K) y Tla temperatura absoluta en Kelvins.
La constante del producto de solubilidad KPS para el ![]() a 25 °C es de 2,62 [8].
a 25 °C es de 2,62 [8].
La actividad del agua se relaciona al coeficiente osmótico ![]() , por la ecuación:
, por la ecuación:
![]()
Donde Mw es la masa molar del agua y la sumatoria toma en cuenta a todas las especies del soluto.
El coeficiente osmótico, necesario para el cálculo de la actividad del agua y el coeficiente de actividad medio, pueden ser calculados a partir del modelo de interacción iónica de Pitzer.
Modelo de Pitzer
El modelo de Pitzer [9, 10, 11], consiste en un conjunto de ecuaciones formuladas por Kenneth Pitzer y sus colaboradores a principios de la década de los años 70.
El coeficiente de actividad medio para una sal binaria pura MX, y el coeficiente osmótico están dados por el siguiente conjunto de ecuaciones:
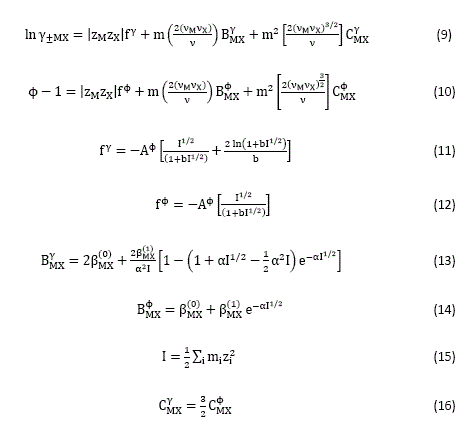
Donde:
y+MX es el coeficiente de actividad medio de la sal MX, Zm y ZX son las valencias del catión M y del anión X respectivamente, vM y vx son el número de iones de M y X y m es la molalidad.
![]() es el coeficiente de Debye-Huckel para la función osmótica y a 25 °C tiene un valor de 0,392 para agua, b es igual a 1,2 y a es igual a 2,0 kg1/2 mol1/2.
es el coeficiente de Debye-Huckel para la función osmótica y a 25 °C tiene un valor de 0,392 para agua, b es igual a 1,2 y a es igual a 2,0 kg1/2 mol1/2.
![]() parámetros del modelo de Pitzer, que deben ser estimados a partir de datos experimentales y que por simplicidad muchas veces se los representa simplemente como
parámetros del modelo de Pitzer, que deben ser estimados a partir de datos experimentales y que por simplicidad muchas veces se los representa simplemente como ![]() .
.
Para sales 2:2 tales como el MgSO4, CaSO4, etc., es necesario incluir un término adicional a la ecuación (13) de acuerdo a:
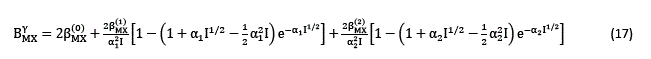
Y a la ecuación (14) de acuerdo a:
![]()
Con ![]() igual a
igual a ![]() .
.
3. Estimación de los parámetros de Pitzer
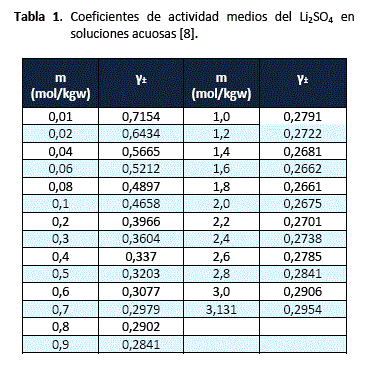
Los datos experimentales de coeficientes de actividad medios del sulfato de litio en función de la molalidad, presentados en la tabla 1, han sido tomados del trabajo realizado por Rard [8], y colaboradores.
Para la estimación de los parámetros de Pitzer se ha utilizado un programa elaborado en el software EXCEL, en base a su subrutina SOLVER, que utiliza el algoritmo denominado GRG (Generalized Reduced Gradient) no lineal en la búsqueda de máximos, mínimos, o valores predeterminados. El programa busca valores de /?(°),/?W y C*, hasta que la función objetivo halle un mínimo.
La función objetivo utilizada fue:
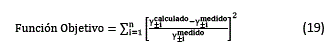
El diagrama de flujo del programa elaborado se presenta en la figura 1.
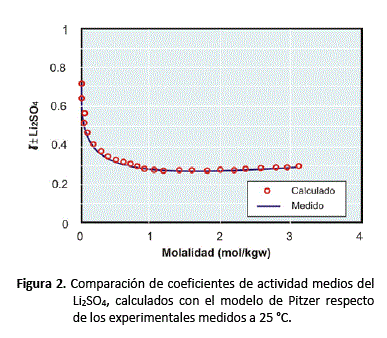
Los valores de ![]() , estimados a partir de los datos experimentales son: 0,14344, 1,12698 y -0,00544 respectivamente. El grado de ajuste entre los coeficientes de actividad calculados respecto de los experimentales es excelente, tal como se puede apreciar en la figura 2.
, estimados a partir de los datos experimentales son: 0,14344, 1,12698 y -0,00544 respectivamente. El grado de ajuste entre los coeficientes de actividad calculados respecto de los experimentales es excelente, tal como se puede apreciar en la figura 2.
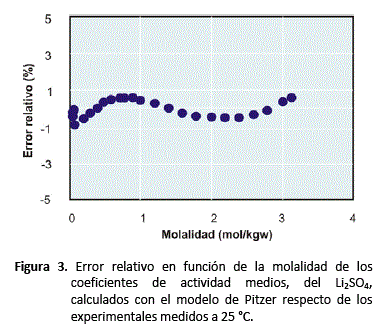
El grado de ajuste, excelente, también se puede apreciar en la figura 3, donde se grafica el error relativo (ecuación 20) de los valores calculados respecto de los valores experimentales. Se puede observar que dicho error tiene un comportamiento sinusoidal, y no sobrepasa los límites de + 1% y -1% de error, durante todo el rango de concentraciones de la solución, desde 0,01 molal hasta saturación.
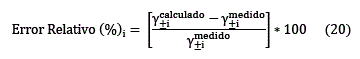
4. Predicción de solubilidades
Para la predicción de solubilidades de sales, se ha elaborado un programa donde los datos de entrada son la constante del producto de solubilidad de la sal y los parámetros del modelo de Pitzer ![]() , correspondientes a dicha sal. El diagrama de flujo de dicho programa se presenta en la figura 4.
, correspondientes a dicha sal. El diagrama de flujo de dicho programa se presenta en la figura 4.
Para un valor KPS de 2,62 a 25 °C, y parámetros del modelo de Pitzer de 0,14344, 1,12698 y -0,00544 anteriormente estimados, el valor calculado para la solubilidad del Li2SO4.H2O es de 3.130 molal. El valor experimental es de 3.131 molal.
Utilizando valores de parámetros del modelo de Pitzer y constantes del producto de solubilidad, reportados en la literatura técnica [7, 10], se han calculado solubilidades para diferentes sales que constituyen la salmuera del Salar de Uyuni. Los resultados se presentan en la tabla 3.
5. Conclusiones
- El modelo termodinámico de interacción iónica de Pitzer, describe con una muy buena exactitud los valores del coeficiente de actividad medio del sulfato de litio. Los valores calculados presentan un error relativo menor al 1% respecto de los valores medidos, en todo el rango de concentraciones desde 0,01 molal hasta saturación.
- Los valores estimados para los parámetros del modelo, ![]() , para el sulfato de litio, en el rango de concentraciones desde 0,01 molal hasta saturación son: 0,14344,1,12698 y-0,00544 respectivamente.
, para el sulfato de litio, en el rango de concentraciones desde 0,01 molal hasta saturación son: 0,14344,1,12698 y-0,00544 respectivamente.
- El valor calculado para la solubilidad del Li2SO4.H2O es de 3,130 molal. El valor experimental es de 3,131 molal.
- Los valores calculados para las solubilidades de diferentes sales, muestran que es posible predecir las solubilidades, utilizando el modelo de Pitzer, con un muy buen grado de exactitud.
6. Referencias bibliográficas
1. RISACHER F.; FRITZ B. "Geochemistry of Bolivian salars, Lipez, southern Altiplano: Origin of solutes and brine evolution". Geochimica et Cosmochimica Acta. Vol. 55, p. 687-705,1991. [ Links ]
2. RISACHER F.; FRITZ B. "Quaternary geochemical evolution of the salars of Uyuni and Coipasa, Central Altiplano, Bolivia". Chemical Geology. 90, p. 211-231,1991. [ Links ]
3. BALDERRAMA F. A. "Recuperación de Litio y Potasio de las Salmueras del Salar de Uyuni". Tesis de Maestría. Oruro: UPC España-UTO Bolivia, 2011. [ Links ]
4. BUTLER J. N. Ionic Equilibrium, a mathematical approach. USA: Addison-Wesley Publishing Company Inc., 1964. [ Links ]
5. GARRELS R. M.; CHRIST C. L. Solutions, Minerals and Equilibria. New York: Ed. Harperand Row, 1965. [ Links ]
6. KIM H. T.; FREDERICK W. J. "Evaluation of Pitzer Ion Interaction Parameters of Aqueous Electrolytes at 25 °C. 1. Single Salt Parameters". Journal of Chemical and Engineering Data. Vol. 33, No. 2,1988. [ Links ]
7. HARVIE C.; WEARE J. "The prediction of mineral solubilities in natural waters: the Na-K-Mg-Ca-Cl-SO4-H2O system from zero to high concentration at 25°C". Geochimica Cosmochimica Acta. Vol. 44, p. 981-997. [ Links ]
8. RARD J. A.; CLEGG S. L.; PALMER D. A. "Isopiestic Determination of the Osmotic and Activity Coefficients of ![]() , and Representation with an Extended Ion-interaction (Pitzer) Model. Journal of Solution Chemistry. January 4, 2007. [ Links ]
, and Representation with an Extended Ion-interaction (Pitzer) Model. Journal of Solution Chemistry. January 4, 2007. [ Links ]
9. PITZER K. "Thermodynamics of Electrolytes. I. Theoretical Basis and General Equations". The Journal of Physical Chemistry. Vol. 77, No. 2,1973. [ Links ]
10. PITZER K.; MAYORGA G. "Thermodynamics of Electrolytes. II. Activity and Osmotic Coefficients for Strong Electrolytes with One or Both Ions Univalent". The Journal of Physical Chemistry. Vol. 77, No. 19,1973. [ Links ]
11. PITZER K.; MAYORGA G. "Thermodynamics of Electrolytes. III. Activity and Osmotic Coefficients for 2-2 Electrolytes". Journal of Solution Chemistry. July 1974, Volume 3, Issue 7, p. 539-546. [ Links ]
12. PERRY R. H.; GREEN D. W. Manual del Ingeniero Químico. Volumen I. Madrid: Ed. Mc Graw Hill, 2001. [ Links ]