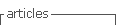Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.39 Oruro Dec. 2016
ARTÍCULOS ORIGINALES
Remoción de Sn y Sb de un concentrado sulfuroso complejo Ag - Pb - Zn
Removal of Sn and Sb from a concentrated sulfur complex Ag-Pb-Zn
Remoção de Sn e Sb de um concentrado sulfuroso complexo Ag-Pb-Zn
Carlos Velasco Hurtado José Cruz Prieto
Carrera de Ingeniería Metalúrgica y Ciencia de Materiales
Universidad Técnica de Oruro cvelascohu@yahoo.es
Resumen
El trabajo muestra los resultados obtenidos en la digestión de un concentrado complejo Ag-Pb-Zn con mezclas de Na2S y NaOH, que tiene en su mineralogía como minerales principales cilindrita y la franckeita, con el objetivo de solubilizar el Sn y el Sb para recuperar estos metales de la solución. Se ha estudiado el efecto de la temperatura, radio molar Na2S/Na2SESTEQUIOMETRICO, concentración de sulfuro de sodio y tiempo de digestión, sobre el grado de extracción de estos metales.
Se han obtenido recuperaciones de antimonio de 95% y de estaño de 80%, con tiempos de digestión de 20 minutos, a una temperatura del proceso 80 X y un radio molar ![]()
Palabras clave. Digestión alcalina, franckeita, cilindrita, remoción de antimonio, remoción de estaño.
Abstract
The paper shows the results of digestion of a concentrated complex of Ag-Pb-Zn with mixtures of Na2S and NaOH having in its mineralogy as main minerals: cylindrite and "frankeita", in order to solubilize the Sn and Sb to recover these metals of the solution. It has been studied the effect of the temperature, molar rate between ![]() , sodium sulfide concentration and digestion time on the degree of extraction of these metals. Recoveries of 95% of antimony and 80% of tin were obtained with digestion times of 20 minutes, at a process temperature of 80 X process and within a molar rate Na2S/Na2Sstoichiometric of 2.
, sodium sulfide concentration and digestion time on the degree of extraction of these metals. Recoveries of 95% of antimony and 80% of tin were obtained with digestion times of 20 minutes, at a process temperature of 80 X process and within a molar rate Na2S/Na2Sstoichiometric of 2.
Keywords: Alkaline digestion, franckeita, cylindrite, antimony removal, tin removal.
Resumo
O trabalho apresenta os resultados da digestão de um concentrado complexo de Ag-Pb-Zn com misturas de Na2S e NaOH que tem na sua mineralogia como minerais principais: cilindrita e frankeita, a fim de solubilizar o Sn e Sb para recuperar estes metais da solução. Foi estudado o efeito da temperatura, a relação molar ![]() , a concentração de sulfureto de sódio e tempo de digestão no grau de extração destes metais. Foram obtidas recuperações de 95% de antimônio e de estanho de 80%, com tempos de digestão de 20 minutos, numa temperatura do processo de 80 °C e num radio molar Na2S/Na2Sestequiométricode 2.
, a concentração de sulfureto de sódio e tempo de digestão no grau de extração destes metais. Foram obtidas recuperações de 95% de antimônio e de estanho de 80%, com tempos de digestão de 20 minutos, numa temperatura do processo de 80 °C e num radio molar Na2S/Na2Sestequiométricode 2.
Palavras chave: Digestão alcalina, franckeita, cilindrita, remoção de antimônio, remoção de estanho.
Introducción
En numerosos yacimientos mineralógicos de Bolivia, se tienen importantes depósitos de minerales del tipo sulfosal, que contienen en su estructura cristalina una variedad de elementos metálicos unidos al azufre, por su composición química se los considera como minerales complejos, para los cuales no existe un tratamiento metalúrgico estándar para la recuperación de sus valores metálicos de importancia económica. Estos yacimientos a pesar de su contenido de metales valiosos, no son explotados debido a la dificultad de comercializar sus productos, o a los bajos precios que se pagan debido a los castigos que se imponen. Entre estos minerales se tienen a la tetraedrita (CuFe)12Sb4S13, tenantita (CuFe)12As4S13, enargita Cu3AsS4, estanina Cu2SnFeS4, andorita AgPbSb3S6, pirargirita Ag3SbS3, jamesonita Pb4FeSb6S14, boulangerita Pb5Sb4S11, franckeita Pb5Sn3Sb2S14, cilindrita Pb3Sn4Sb2S14, entre otros.
La franckeita es un mineral boliviano característico, tiene la fórmula Pb5Sn3Sb2S14 ha sido formado a baja temperatura en los yacimientos argento estanníferos terciarios, con formación posterior a la teallita [1]; la cilindrita Pb3Sn4Sb2S14 es también un mineral hidrotermal, con paragénesis con la franckeita y la jamesonita, se presenta en vetas hidrotermales de estaño, asociado a la franckeita, estannina, jamesonita y esfalerita [2].
El uso de sulfuro de sodio o mezclas de sulfuro de sodio + hidróxido de sodio para la recuperación de sulfuros simples y sulfosales ha sido estudiado por numerosos investigadores. De manera general, se reporta que la velocidad de disolución de Sb, As y Sb de estos minerales tiene una cinética bastante lenta, se requieren soluciones de sulfuro de sodio concentradas y calientes y un mineral en grano fino para solubilizar estos metales. Achimovicá y Baláz [3], reportan que en la tetrahedita, enargita y jamesonita la lixiviación convencional con sulfuro de sodio es muy efectiva, en tanto que la franckeita es refractaria a este tipo de tratamiento.
En este trabajo se discute la digestión de un concentrado sulfuroso que tiene en su composición mayoritariamente franckeita y cilindrita con una solución concentrada de Na2S-NaOH, seguida de una lixiviación con agua. Este nuevo proceso ha sido estudiado por Ruiz, Bello y Padilla [4], para la remoción de arsénico de concentrados de cobre, con elevados grados de extracción y una rápida cinética del proceso.
En la solución de sulfuro de sodio, el sulfuro de antimonio y el sulfuro de estaño forman sulfosales solubles de sodio de acuerdo a [5, 6, 7, 8, 9,10,11,12]:
![]()
El NaOH se añade a la solución para evitar la hidrólisis del Na2S:
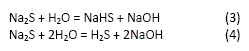
El NaOH puede disolver al Sb2S3, el proceso es representado por la reacción (12,13,14,15,16):
![]()
Materiales y métodos
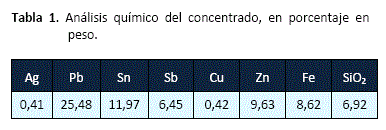
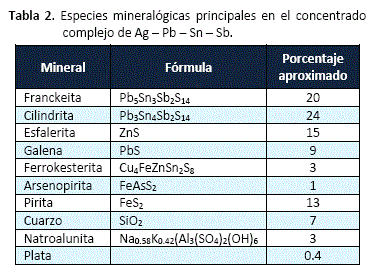
Para la investigación, se ha utilizado una muestra de concentrado complejo de Pb-Ag-Sn-Sb. Más del 80% de las partículas minerales tienen un tamaño menor a 65# Tyler. La tabla 1, presenta el análisis químico del concentrado, la figura 1, el análisis de difracción de rayos X y la tabla 2, las especies mineralógicas principales del concentrado.
Las pruebas de digestión fueron realizadas disolviendo el concentrado complejo en una solución concentrada de sulfuro de sodio como lixiviante alcalino e hidróxido de sodio, para determinar el efecto de los siguientes parámetros: temperatura, radio molar ![]() , concentración de sulfuro de sodio y tiempo de digestión. La concentración de hidróxido sódico en todas las pruebas se mantuvo constante en 4 moles/l, salvo en aquellas en las que se estudió el efecto de este reactivo en el proceso.
, concentración de sulfuro de sodio y tiempo de digestión. La concentración de hidróxido sódico en todas las pruebas se mantuvo constante en 4 moles/l, salvo en aquellas en las que se estudió el efecto de este reactivo en el proceso.
La solución lixiviante fue primero añadida al reactor (20 ml), calentada, y cuando se alcanzó la temperatura deseada, fueron añadidos diez gramos de muestra. La pulpa formada en el reactor fue agitada mecánicamente con una pastilla magnética a 530 rpm, y mantenida a la temperatura de la prueba mediante un baño de agua cuya temperatura fue controlada mediante un termostato. La temperatura de la pulpa fue medida de manera continua con un termómetro. Las pérdidas de líquido por evaporación fueron repuestas también de manera continua. Como reactivos se utilizaron sulfuro de sodio MERCK de calidad para análisis, con 33 a 38% de pureza, y un contenido entre 7 a 10 moléculas de agua, e hidróxido de sodio de calidad para análisis.
Una vez concluido el tiempo de digestión, la pulpa se transfirió a un vaso de precipitado y se completó el volumen a 500 ml mediante la adición de agua destilada calentada previamente, y se lixivió bajo agitación durante una hora a 80 °C. Finalmente, se filtró el producto lixiviado, el residuo sólido fue secado y pesado, y se tomaron muestras de sólido y solución para análisis químico.
Resultados
En el proceso de digestión el concentrado se pone en contacto con pequeños volúmenes de una solución concentrada del agente lixiviante, de manera que se tiene en el reactor un elevado porcentaje de sólidos y una solución con una concentración cercana a su valor de saturación, lo que ocasiona un ataque intenso del sólido. La cantidad de sulfuro de sodio utilizada en la digestión, es la misma que en el proceso de lixiviación convencional.
En las pruebas realizadas, a falta de mayor información sobre la química del proceso de disolución de antimonio y estaño de la cilindrita y franckeita en soluciones de sulfuro de sodio, para el cálculo de la cantidad de sulfuro de sodio se utilizaron las reacciones (1) y (2). Las dosificaciones de sulfuro de sodio se expresan como múltiplos de la cantidad estequiómetrica calculada para lixiviar todo el estaño y antimonio presentes en la muestra, de acuerdo a las reacciones mencionadas.
La lixiviación con agua del producto de la digestión tiene el objetivo de solubilizar las tiosales formadas, y fue realizada en todas las pruebas bajo las condiciones indicadas anteriormente, y en esta solución se realizaron los análisis químicos de las especies solubles para evaluar el experimento.
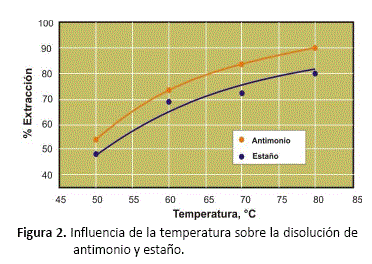
Influencia de la temperatura de digestión
La dependencia de la disolución de antimonio y estaño con la temperatura se muestra en la figura 2. Las pruebas experimentales se realizaron con el doble de la cantidad estequiométrica de sulfuro de sodio, en el rango de temperatura entre 50 y 80 °C, y tiempos de digestión de 20 minutos. No fueron estudiadas temperaturas mayores a 80°C, debido a que se producía demasiada evaporación de líquido, puesto que el laboratorio donde se realizaron las pruebas experimentales está situado por encima de los 3.700 m.s.n.m, y la temperatura de ebullición del agua es de 87 °C.
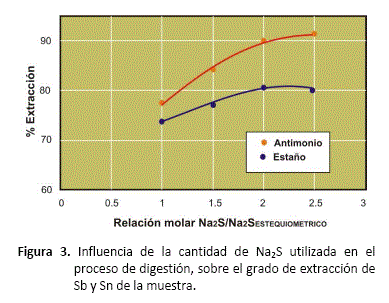
Influencia del exceso de Na2S
La influencia de la cantidad de sulfuro de sodio utilizada en la digestión del concentrado complejo se muestra en la figura 3. Las pruebas experimentales fueron realizadas a una temperatura de digestión de 80 °C y dosificaciones de Na2S desde el valor estequiométrico, hasta 2.5 veces el requerimiento estequiométrico, según las reacciones (1) y (2).
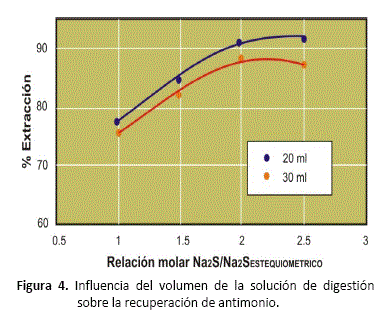
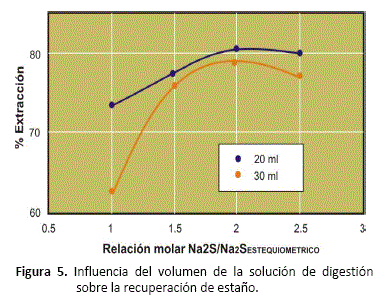
Efecto del volumen de la solución de digestión
Se ha comparado los resultados obtenidos en la extracción de antimonio y estaño del concentrado, variando el volumen de la solución. Se han realizado las pruebas experimentales usando 20 y 30 ml de solución, temperatura de 80°C y sulfuro de sodio desde el requerimiento estequiométrico hasta 2.5 veces éste valor. Las figuras 4 y 5, muestran los resultados obtenidos.
Tiempo de digestión
Esta variable que está estrechamente ligada con la cinética del proceso, ha sido estudiada bajo las siguientes condiciones experimentales: temperatura 80 °C, sulfuro de sodio 1,5 veces el requerimiento estequiométrico, volumen de solución 20 ml.
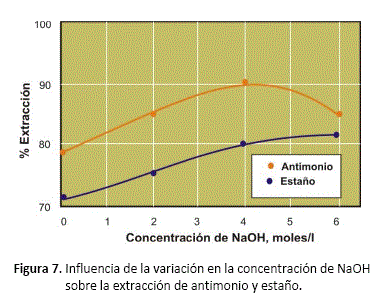
Concentración de NaOH
Para analizar el rol que cumple el hidróxido sódico en el proceso de digestión, se han realizado pruebas experimentales variando la concentración de este reactivo desde 0 hasta 6 molar, realizando la digestión a 80 °C, sulfuro de sodio dos veces el requerimiento teórico, en un tiempo de 20 minutos.
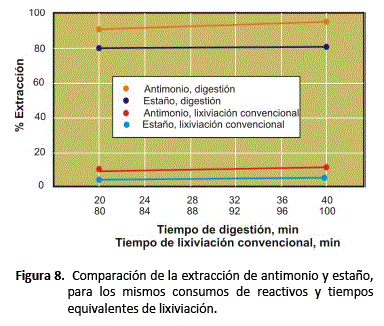
Comparación entre la digestión alcalina y la lixiviación convencional
Con el objeto de comparar los resultados de lixiviar la muestra por el proceso de digestión con los de la lixiviación convencional, se han realizado pruebas a 80°C y dos veces el requerimiento estequiómetrico de sulfuro de sodio. En el caso de la digestión alcalina, se han utilizado 20 ml de solución, y se ha digerido por 20 y 40 minutos seguida de lixiviación con agua del producto de digestión por 60 minutos. La lixiviación convencional se realizó a tiempos de 80 y 100 minutos, equivalentes a la suma de los tiempos de ataque y solubilización con agua del proceso de digestión, con el mismo peso de Na2S y NaOH utilizados en la digestión alcalina.
Estos resultados que la lixiviación con agua posterior a la digestión, sólo sirve para disolver los compuestos solubles ya formados.
Residuos de la digestión
Los residuos del proceso han sido caracterizados por análisis químicos y difracción de rayos X. Los análisis de rayos X muestran que en el proceso de digestión la estructura cristalina de la franckeita y la cilindrita queda totalmente destruida, y en el residuo se identifica la presencia de sulfuros simples como la galena PbS, esfalerita ZnS, esfalerita ferrosa ![]() , pirita FeS2, principalmente; además de minerales de ganga.
, pirita FeS2, principalmente; además de minerales de ganga.
Discusión de resultados
Los resultados obtenidos muestran que el proceso de digestión de concentrados complejos con contenidos de cilindrita y franckeita, permite obtener elevadas extracciones de antimonio y estaño. Las gráficas del % extracción de estos metales contra el valor de la variable estudiada, muestran la misma tendencia para estos metales en todas las variables estudiadas. Durante la digestión de estos minerales, éstos se descomponen y los sulfuros de estaño y antimonio presentes en los minerales reaccionan con los iones sulfuro para formar los compuestos solubles Na3SbS3 y Na2SnS3, mientras otros componentes del concentrado, como los sulfuros de plomo, zinc y hierro, por ser insolubles en soluciones de sulfuro, permanecen en la fase sólida, como se muestra en el análisis de rayos X del producto de lixiviación mostrado como ejemplo en la figura 9. En las gráficas que muestran los resultados obtenidos, se observa que para todas las variables estudiadas la extracción de antimonio es siempre mayor a la extracción de estaño.
Otra ventaja del proceso es la elevada velocidad de disolución de ambos minerales en las soluciones de sulfuro. Como se observa en la figura 6, la digestión de la muestra es muy rápida bajo las condiciones estudiadas, con valores de extracción de 62,5% y 75,5% para el Sn y Sb, respectivamente, en un tiempo de digestión 5 minutos, comparada con los pequeños valores de extracción obtenidos por lixiviación convencional para los mismos consumos de Na2S y NaOH y tiempos mayores de proceso (figura 8). Esta rápida cinética del proceso se debe a la alta reactividad de la solución lixiviante concentrada, muy alcalina y caliente.
La cilindrita y la franckeita son considerados materiales refractarios al proceso de lixiviación convencional con mezclas de Na2S + NaOH [3]. En el proceso estudiado, se obtuvieron elevadas extracciones de estaño y antimonio de estos minerales en un tiempo de digestión corto (20 minutos), en comparación con las recuperaciones obtenidas por lixiviación convencional de otros minerales considerados fáciles de lixiviar por un proceso convencional, como son la tetrahedita [6, 7], jamesonita [8, 9, 17, 18, 19], y aún sulfuros simples [10, 13, 20, 21], que para las mismas temperaturas y consumos de Na2S, con tiempos de lixiviación en el rango de horas, en muchos casos no alcanzan a superar el 70% de extracción.
El proceso es fuertemente influenciado por la temperatura. Los resultados mostrados en la figura 2, permiten observar que el grado de extracción de estaño y antimonio mejora con la elevación de la temperatura de la solución de digestión. Los mejores valores de extracción se consiguieron para la digestión a 80 °C, con valores de 80,61% para el estaño y 90,5% para el antimonio.
En el caso de la cantidad de sulfuro de sodio dosificado, tanto para la extracción de antimonio como para la de estaño se tiene una mejora proporcional a la cantidad de éste reactivo hasta valores del doble del requerimiento estequiométrico. Incrementos de sulfuro de sodio por encima de este valor, no mejoran de manera significativa la extracción de estos metales.
Asimismo, se ha determinado que para un mismo peso de concentrado y de Na2S cargados al reactor, cuando se disminuye el % sólidos en la solución de digestión, disminuye también el grado de solubilización de antimonio y estaño. El cambio en el volumen de digestión afecta principalmente a la concentración de sulfuro de sodio y al porcentaje de sólidos en la pulpa, (figuras 4 y 5).
En las pruebas realizadas variando la concentración de NaOH en la mezcla de sulfuro de sodio e hidróxido de sodio, los resultados obtenidos que se resumen en la figura 7, muestra que es posible solubilizar el antimonio y el estaño presente en el concentrado utilizando sulfuro de sodio sin la presencia de hidróxido de sodio, pero con grados de extracción menores. Este hecho permite afirmar que la reacción entre cilindrita y franckeita con sulfuro de sodio es más rápida que la reacción de estos minerales con hidróxido de sodio, bajo las condiciones en las que se realizó el estudio. Sminčáková y Raschman [15], reportan este mismo comportamiento para la lixiviación de antimonita natural con mezclas de estos dos reactivos alcalinos.
En las pruebas realizadas en ausencia de hidróxido de sodio, se tuvo la hidrólisis del sulfuro de sodio y la formación de gas sulfhídrico, que disminuye la cantidad de sulfuro de sodio disponible para la digestión, pero además ocasiona problemas de contaminación atmosférica.
El incremento de la concentración de NaOH ocasiona una disminución de la extracción de antimonio para concentraciones de este reactivo mayores a cuatro molar. A concentraciones elevadas de hidróxido de sodio, se incrementa la solubilidad de oxígeno en la solución, y el tioantimonato de sodio puede precipitar de acuerdo a la reacción [8]:
![]()
La presencia del Na2S2O3 disminuye la solubilidad del Sb2S3 en la solución, y por lo tanto, tiene un efecto negativo sobre la lixiviación. La disminución en el porcentaje de extracción de antimonio en el estudio realizado, es debida a esta reacción.
Tiancong [22], muestra que el NaOH añadido, además de dar un pH alcalino a la solución, disminuye la proporción de sulfito formado:
![]()
En el proceso de digestión alcalina, el rol principal del NaOH sería el de evitar la hidrólisis del sulfuro de sodio, y disminuir la formación del compuesto Na2S2O3.
A partir de los análisis de difracción de rayos X de los productos de digestión, que muestran que en el sólido resultante sólo existen sulfuros simples y minerales de ganga, y a la los análisis químicos de las soluciones y sólidos obtenidos, se sugiere que las reacciones químicas que ocurren en el proceso serían:
![]()
Conclusiones
La digestión alcalina de franckeita y cilindrita es un proceso que permite la separación de antimonio y estaño de los minerales, con elevados grado de extracción y tiempos cortos de proceso.
Elevadas temperaturas de la solución y exceso de NaSS respecto del requerimiento estequiométrico, favorecen el grado de extracción de estaño y antimonio. Las mejores extracciones de estos metales se han obtenido a temperaturas de 80 °C, usando dos veces el requerimiento estequiométrico de Na2S y una concentración de cuatro moles/l de hidróxido sódico.
La disolución de estaño y antimonio con mezclas de Na2S y NaOH se debe principalmente a la acción del sulfuro de sodio, mientras que el rol del NaOH es principalmente mantener un ambiente alcalino para evitar la hidrólisis del sulfuro de sodio.
La utilización de concentraciones mayores a 4 moles/l de NaOH favorece la precipitación de antimonio como 2NaSb(OH)6, al favorecer este reactivo la solubilidad de oxígeno en la solución de digestión.
Los principales elementos de valor comercial en el concentrado estudiado son la plata y el estaño. Luego del proceso de digestión se obtiene una solución de la cual puede recuperarse el estaño, y un residuo sólido de composición química menos compleja, de la cual se puede recuperar más fácilmente la plata.
Referencias
1. RIVAS Salomón y AHLFELD Federico. Los minerales de Bolivia y sus parajes. Santa Cruz de la Sierra, Bolivia, 1998. [ Links ]
2. KEMPFF, O.; PARA, W. H.; TAWACKOLI, S. Minerales de Bolivia. La Paz - Bolivia. Comunicaciones El País S. A., 2009. [ Links ]
3. ACHIMOVIČOVÁ, M.; BALÁ, P. "Kinetics of the leaching of mechanically actived berthierite, bolulangerite and franckeite". Phys. Chem. Minerals. N° 35, p. 95 - 101, 2008. [ Links ]
4. RUIZ, María Cristina; BELLO, Ricardo; PADILLA, Rafael. "Remoción de arsénico desde concentrados de cobre que contienen enargita". Revista Metalúrgica. Universidad Técnica de Oruro. Oruro: Ed. Universitaria, 33, p. 16 - 20, 2013. 2078-5593. [ Links ]
5. HABASHI, Fathi. Principles of extractive metallurgy, Tomo 2, Hidrometallurgy. Segunda edición. USA: Gordon and Breach Science Publishers, ISBN 0 677 01780 4,1980. [ Links ]
6. AWE, Samuel y SANDSTRÖM, A. "Selective leaching of arsenic and antimony from tetrahedrite rich complex sulphide concentrate using alkaline sulphide solution". Minerals Engineering, 23, p. 1227 - 1236, 2010. [ Links ]
7. AWE, Samuel y SANDSTRÖM, Å. "Tratamiento hidrometalúrgico de un concentrado de cobre con contenido de tetraedrita. Minería, 439, p. 46 - 52, 2014. [ Links ]
8. YANG Tian Zu; JIANG Ming-xi; LAI Qiong-lin; CHEN Jin-zhong. "Sodium sulfide leaching of low grade jamesonite concentrate in production of sodium pyroantimoniate". Journal Central South University Technology, China, Vol. 12, N°3, p. 290 - 294, junio de 2005. [ Links ]
9. BALDERRAMA Fausto. "Remoción de antimonio de los concentrados del Centro Minero San José". En: Anales del Congreso Nacional de Metalurgia y Ciencia de Materiales. SALAS A. y SILES D. (Eds.), Primera edición. Bolivia, 1994. [ Links ]
10. UBALDINI, S.; VEGLIO, F.; FORNARI, P.; ABBRUZZESE, C. "Process flow-sheet for gold antimony recovery from stibnite". Hydrometallurgy. 57, p. 187 - 199, 2000. [ Links ]
11. CRUZ P., José Luis. "Remoción de Sn y Sb de concentrados de cilindrita y franckeita por digestión alcalina". Tesis de licenciatura. Tutor: Carlos Velasco Hurtado. Oruro: Universidad Técnica de Oruro, Carrera de Ingeniería Metalúrgica, 2015. [ Links ]
12. SMINČÁKOVÁ, Emilia; KOMOROVÁ, L'udmila. "Kinetika lúhovania Sb2S3 v roztoku NaOH". Acta Montanistica Slovaca. Rocnick 12, p. 328 - 333, 2007. [ Links ]
13. SMINČÁKOVÁ Emilia; RASCHMAN Pavel. "Leaching of stibnite by mixed Na2S and NaOH solutions". Acta Technica Corviniensis. University Politehnica Timisoara, Rumania: Tomo 5, fasciculo 1, p. 35 - 39, 2012. [ Links ]
14. SMINČÁKOVÁ, Emilia; KOMOROVÁ. "Leaching of stibnite in a NaOH solutions". Annals of the Faculty of Engineering Hunedoara. Journal of Engineering. Tomo VI, Eslovaquia, 2008. [ Links ]
15. SMINČÁKOVÁ Emilia; RASCHMAN Pavel. "Leaching of natural stibnite using Na2S and NaOH solutions". International Journal of Energy Engineering. Vol. 1, No 2, p. 85 -89, 2011. [ Links ]
16. DODANGEH, A.; HALALI, M.; HAKIM, M.; BAKHSHANDEH, M. R. "Leaching kinetics of stibnite in sodium hydroxide solution". IJE Transaction B. Vol 27, No 2, p. 325-332, 2014. [ Links ]
17. AZAÑERO, A.; NUÑEZ, P. A.; FIGUEROA, A.; FERNANDEZ, S.; CABALLERO, M.; CHÁVEZ; X., VALENZUELA, A. "Lixiviación de concentrados Pg/Ag con alto contenido de As/Sb". Revista del Instituto de investigación FIGMMG. Universidad Mayor de San Marcos, vol. 7, N° 14, p. 9 - 15, 2004. [ Links ]
18. ZAMBRANA José, FERNANDEZ Juan. Lixiviación de antimonio de concentrados complejos con Na2S. Oruro -Bolivia. Informe Técnico 690-628,I.I.M.M, 1975. [ Links ]
19. BALÁZ P, ACHIMOVIČOVÁ, M. "Selective leaching of antimony and arsenic from mechanically active tetrahedrite, jamesonite and enargite". International Journal of Mineral Processing. N° 81, p. 297 - 307, 2006. [ Links ]
20. RIVERO, David. "Cinética de la lixiviación de antimonita en solución de sulfuro de sodio". Tesis de licenciatura. Tutor: René Antezana García. Oruro: Universidad Técnica de Oruro, Carrera de Ingeniería Metalúrgica. 1982. [ Links ]
21. QUIÑONES, Alberto. "Recuperación de estaño contenido en colas mediante conversión a tiosales solubles". Tesis de Licenciatura. Tutor: José Zambrana Vargas. Oruro: Universidad Técnica de Oruro, Carrera de Ingeniería Metalúrgica, 1983. [ Links ]
22. TIANCONG, Z. The Metallurgy of Antimony. The People's Republic of China: Central South University of Technology Press, Changsa, 1988. [ Links ]
23. MANTELL, C. L. Tin, its mining, production, technology and applications. USA: Rehinhold Publishing Corporation, 1949. [ Links ]
24. ANDERSON, Corby. "The Metallurgy of antimony". Chemie der Erde. N° 72, p. 3 - 8, 2012. [ Links ]
25. ANDERSON, C. G.; TWIDWELL, L. G. "The Alkaline sulfide hydrometallurgical separation, recovery and fixation of tin, arsenic, antimony, mercury and gold". The Southern African Institute of Mining and Metallurgy. 2008. [ Links ]